
Paula Wolfert zitiert in ihrem Standardkochbuch zur Südwestfranzösischen Küche des Gaskonischen Koch Maurice Coscuella mit folgenden Worten:
„Have you noticed there are some salts that don’t actually salt?“ He went on to explain that some salts are much saltier than others, some are merely salty, and others have a real flavor.
Dennoch: immer wieder ignoriert man diese Vielfalt in vielen Rezepten, in denen nur die Rede von „einer Messerspitze Salz“ ist oder nur die Anweisung zu lesen ist, das Gericht „zu salzen“. So kann man zum Würzen eines Gigot à la Bordelaise entweder ein jodiertes Speisesalz verwenden, das mit einer Art Wasserstaubsauger aus den Bergwerken gespült wird, oder aber ein zartrosa fleur de sel von der Ile de Ré oder aus der Guérande, eine hauchdünne oberflächlichen Kruste, die vorsichtig von den Salzbetten am Meer abgekämmt wird, bevor sie sich mit dem gewöhnlichen sel gris vermischen kann.
Zum einen unterscheiden sich Form und Textur der beiden: das eine Salz besteht aus relativ regelmäßigen kubischen Kristallen und knirscht beim Zerkauen auf den Zähnen, während das andere zwar knusprig ist, aber förmlich auf der Zunge schmilzt. Zum anderen kann man auch Geschmacksunterschiede erkennen: dem oft etwas stechend-salzigen Aroma des Speisesalzes steht ein leicht algig-meeriger Geschmack der Salzblume gegenüber. Man vermutet, dass im fleur de sel Spuren von Fetten und Algenaromastoffen enthalten sind, die durch den natürlichen Trocknungsprozess in das Salz gelangen. McGee schreibt dazu:
This is possible, since the interface between water and air is where aroma molecules and other fatty materials would concentrate; but to date the aroma of sea salts has not been much studied.
Salz ist also nicht gleich Salz.
Tatsächlich gibt es nur wenige wissenschaftliche Artikel, die sich mit diesem Stoff auseinandersetzen – eine verschwindende Zahl, wenn man sie zum Beispiel mit der Fachliteratur zu Parmesan oder Balsamico vergleicht. Das ist auch deshalb erstaunlich, weil einer unserer 5+x Geschmackssinne extra auf diesen Stoff spezialisiert ist, einen Stoff, der in anderen Lebensmitteln wie Früchten oder Fleisch nicht nennenswert vorkommt. Wäre nicht die Fähigkeit, zwischen Salzwasser und Trinkwasser zu diskriminieren, überlebenswichtig für die Spezies, dann könnte man hier fast an ein intelligent design glauben, das den Menschen perfekt dafür ausstatten, mit der Hilfe von Salz seine Nahrungsmittel in Genussmittel zu transformieren.

 Eine schönes Beispiel für die radikale Verwissenschaftlichung des Kochens bzw. der Rezeptkreation ist die Suche nach bestimmten Passungen in den „Odor Activitiy Values“ der Grundzutaten, wie sie Hervé This und Heston Blumenthal gerne anwenden. Hier macht die molekulare Küche ihrem Namen alle Ehre, denn es geht tatsächlich um die molekularen Bestandteile des (guten) Geschmacks. Das Prinzip
Eine schönes Beispiel für die radikale Verwissenschaftlichung des Kochens bzw. der Rezeptkreation ist die Suche nach bestimmten Passungen in den „Odor Activitiy Values“ der Grundzutaten, wie sie Hervé This und Heston Blumenthal gerne anwenden. Hier macht die molekulare Küche ihrem Namen alle Ehre, denn es geht tatsächlich um die molekularen Bestandteile des (guten) Geschmacks. Das Prinzip  Noch etwas wissenschaftlicher ist das Vorgehen, in Aufsätzen aus Fachjournalen wie dem Journal of Agricultural and Food Chemistry nach den „Odor Activity Values“ (OAVs) der Zutaten sowie ihren Wahrnehmungsschwellen zu suchen. Diese lassen sich errechnen, indem man die Konzentration der flüchtigen Aromastoffe durch den sensorischen Schwellenwert teilt. Ein Wert von 100 bedeutet dementsprechend, dass die Konzentration eines Aromamoleküls 100 Mal höher ist als die Wahrnehmungsschwelle. Wer einen
Noch etwas wissenschaftlicher ist das Vorgehen, in Aufsätzen aus Fachjournalen wie dem Journal of Agricultural and Food Chemistry nach den „Odor Activity Values“ (OAVs) der Zutaten sowie ihren Wahrnehmungsschwellen zu suchen. Diese lassen sich errechnen, indem man die Konzentration der flüchtigen Aromastoffe durch den sensorischen Schwellenwert teilt. Ein Wert von 100 bedeutet dementsprechend, dass die Konzentration eines Aromamoleküls 100 Mal höher ist als die Wahrnehmungsschwelle. Wer einen 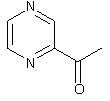 Nun
Nun 


 In der
In der 
 Die beiden israelischen Forscher
Die beiden israelischen Forscher 


